初めて化学を学ぶ高校生のみなさんへ
先日もテレビを見ていると高校生の皆さんが「化学なんて将来家庭生活で要らないのだから、大部分の生徒について高校で教える必要はない」といっていました。ところが私も“主夫”兼“介護業”をしてみますと、化学が役に立つのです。後で記したダイオキシン問題もそうですが、別の例を挙げましょう。キッチンハイターは布巾の漂白や、家内の栄養剤を流し込む器具の消毒にも使います。まずキッチンハイターは強いアルカリ性を示します。こういう性質のものは皮膚についたまま放置するとひどく皮膚を痛めるということを知っていないといけません。また消毒後の器具は充分水で洗浄しないと万一キッチンハイターが胃に入ると、胃の中の塩酸と反応して猛毒の塩素を発生します。これらはすべて高校で習ったことの応用に過ぎません。
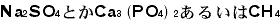 と書かれます。最初にアルファベットを使ったのはベルツェリウスというスエーデンの人です。1814年のことでした。最後の例は有機化合物ですが、有機化合物では
と書かれます。最初にアルファベットを使ったのはベルツェリウスというスエーデンの人です。1814年のことでした。最後の例は有機化合物ですが、有機化合物では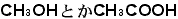 というように示性式でまず書かれます。これらの化学式をプラスや矢印でつないで化学反応式が書かれて、どういうことが起こったのかが示されます。いわば化学式が「単語」で化学反応式が「文章」なのです。NaとかSとかOは単語を造る「アルファベット」といえます。物質を化学式で書くことが初心者にはまず最初の障壁になるのですが、化学式で表現すると豊富な内容を中に含んでいるので、慣れてくるといろいろのことを読み取れるようになります。これは日本語や英語からは期待できないものなのです。化学の国を旅行しようとすると化学語を使わなくてはならないのです。日本語や英語はそこで観たことの解説に使うだけです。
というように示性式でまず書かれます。これらの化学式をプラスや矢印でつないで化学反応式が書かれて、どういうことが起こったのかが示されます。いわば化学式が「単語」で化学反応式が「文章」なのです。NaとかSとかOは単語を造る「アルファベット」といえます。物質を化学式で書くことが初心者にはまず最初の障壁になるのですが、化学式で表現すると豊富な内容を中に含んでいるので、慣れてくるといろいろのことを読み取れるようになります。これは日本語や英語からは期待できないものなのです。化学の国を旅行しようとすると化学語を使わなくてはならないのです。日本語や英語はそこで観たことの解説に使うだけです。
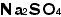 と表現できなければ駄目です。逆に
と表現できなければ駄目です。逆に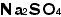 は「硫酸ナトリウム」だなと、すぐに解釈できなければなりません。有機化合物の
は「硫酸ナトリウム」だなと、すぐに解釈できなければなりません。有機化合物の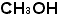 についても同様です。私の経験ではこれができるようになれば高校での化学への障害は大部分消えてしまいます。高校化学を半分までマスターできたといっても良いくらいです。
についても同様です。私の経験ではこれができるようになれば高校での化学への障害は大部分消えてしまいます。高校化学を半分までマスターできたといっても良いくらいです。
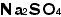 、メタノールは
、メタノールは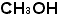 と丸暗記は駄目です。無機化合物を大きく分けるとイオン性化合物と、分子性の化合物になります。CO(一酸化炭素)や
と丸暗記は駄目です。無機化合物を大きく分けるとイオン性化合物と、分子性の化合物になります。CO(一酸化炭素)や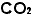 (二酸化炭素)、NO(一酸化チッソ)や
(二酸化炭素)、NO(一酸化チッソ)や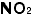 (二酸化チッソ)のように気体は分子性ですが、その他はたいていイオン性です。分子性のものは丸暗記します(有機化合物についてはこうも言えないのです。もう少し後の方で触れますからそちらで読んでください)が、イオン性のものは陽イオンと陰イオンを組み合わせて作ります。そのためには教科書のどこかに出ているイオンの表でイオンの「名前」を「価数」と一緒に確実に覚えます。紙に書きながら手にも覚えさせるとよいでしょう。たとえばナトリウムイオンは
(二酸化チッソ)のように気体は分子性ですが、その他はたいていイオン性です。分子性のものは丸暗記します(有機化合物についてはこうも言えないのです。もう少し後の方で触れますからそちらで読んでください)が、イオン性のものは陽イオンと陰イオンを組み合わせて作ります。そのためには教科書のどこかに出ているイオンの表でイオンの「名前」を「価数」と一緒に確実に覚えます。紙に書きながら手にも覚えさせるとよいでしょう。たとえばナトリウムイオンは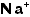 、硫酸イオンは
、硫酸イオンは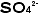 です。イオンの名前に関連して少し横道に入ります。私の教えた生徒で住谷亜人君と言う人がいました。亜人は何と読むのでしょう。答えはツグトです。亜=ツぐです。
です。イオンの名前に関連して少し横道に入ります。私の教えた生徒で住谷亜人君と言う人がいました。亜人は何と読むのでしょう。答えはツグトです。亜=ツぐです。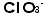 は塩素酸イオンで、
は塩素酸イオンで、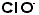 はOの数が3の次の次の1ですから「次次塩素酸」イオンと言いたいところですが、発音上「次塩素酸」と紛らわしいからでしょう、「次亜塩素酸」イオンとなったのです。イオン式を覚えてしまえば硫酸ナトリウムは、この二つを組み合わせ、かつ価数をバランスさせるように考えるのです。ナトリウムイオンは+1価、硫酸イオンは-2価ですから硫酸イオン1個に対しナトリウムイオンは2個要ります。日本では陽イオンの方を前に書きます(本来読む順に並べるのです。英語ではsodium sulfate 、ドイツ語ではNatrium Sulfatですから、ナトリウムイオンが前になるのです。日本は化学については後進の輸入国ですから、英語やドイツ語の書き順を採用したのです。日本語で読む順になっておらずひっくり返ります)。硫酸カルシュウムは
はOの数が3の次の次の1ですから「次次塩素酸」イオンと言いたいところですが、発音上「次塩素酸」と紛らわしいからでしょう、「次亜塩素酸」イオンとなったのです。イオン式を覚えてしまえば硫酸ナトリウムは、この二つを組み合わせ、かつ価数をバランスさせるように考えるのです。ナトリウムイオンは+1価、硫酸イオンは-2価ですから硫酸イオン1個に対しナトリウムイオンは2個要ります。日本では陽イオンの方を前に書きます(本来読む順に並べるのです。英語ではsodium sulfate 、ドイツ語ではNatrium Sulfatですから、ナトリウムイオンが前になるのです。日本は化学については後進の輸入国ですから、英語やドイツ語の書き順を採用したのです。日本語で読む順になっておらずひっくり返ります)。硫酸カルシュウムは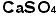 ,硫酸アルミニウムは
,硫酸アルミニウムは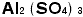 になりますね。
になりますね。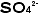 というイオンは一つのグループですから、2個以上要るときは( )を付けるのです。 Naは一つの原子記号ですから
というイオンは一つのグループですから、2個以上要るときは( )を付けるのです。 Naは一つの原子記号ですから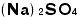 と書くと誤りです。また、ヘキサシアノ鉄(Ⅱ)酸イオンのイオン式は
と書くと誤りです。また、ヘキサシアノ鉄(Ⅱ)酸イオンのイオン式は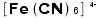 で[ ]はこのイオンが錯イオンだということを示しています。ヘキサというのはギリシャ語で「6」のことです。複数個要るとき、例えばヘキサシアノ鉄(Ⅱ)酸鉄(Ⅲ)ですと
で[ ]はこのイオンが錯イオンだということを示しています。ヘキサというのはギリシャ語で「6」のことです。複数個要るとき、例えばヘキサシアノ鉄(Ⅱ)酸鉄(Ⅲ)ですと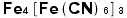 となります。
となります。
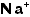 で少しちがうだけですが、実体はまったく異なった性質のものです。ナトリウムは水と激しく反応して水素を発生しますが、ナトリウムイオンは食塩の成分の一つで、水と反応はしません。硫酸イオンと硫酸もまったく別のものです。~酸というのは~酸水素として式を考えればよいのです。CoとCOはちがう物質です。一つ一つのちがった言葉・定義の意味をがっちり厳密に把握し理解しないと自然科学はやれません。
で少しちがうだけですが、実体はまったく異なった性質のものです。ナトリウムは水と激しく反応して水素を発生しますが、ナトリウムイオンは食塩の成分の一つで、水と反応はしません。硫酸イオンと硫酸もまったく別のものです。~酸というのは~酸水素として式を考えればよいのです。CoとCOはちがう物質です。一つ一つのちがった言葉・定義の意味をがっちり厳密に把握し理解しないと自然科学はやれません。
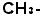 (メチル基)、
(メチル基)、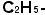 (エチル基)のような骨組みの基(炭化水素基)と性質を決める働きの機能団(官能基)例えば-OH (ヒドロキシ基:アルコールかフェノールの性質を示す)、-COOH (カルボキシ基:カルボン酸の性質を示す)などです。これを組み合わせて示性式を作るのです。示性式から構造式を作るのは定石がありますからそれほど難しくありません。分子の存在するものは分子の構造を知れば”構造から性質を”が鉄則ですから、いろいろなことを読みとれます。分子模型はその意味で大事なものですが、スイス製のよいものですと1セット50万円くらいはします。構造式は立体としての感覚は欠けていますが、この模型の代用品です。分子そのものの「見取り図」です。(歴史的には示性式、構造式は人間が有機化合物を分類する為に便宜上考えた形式的なもので、実際の分子の形とは関係がないとされた時代があります。だからこそ未だに○○式といっていますが、現代では、実際の分子の形と密接に関係していることが機器分析からも証明できますから、分子の示性スケッチ、構造スケッチと考えればよろしい。昔の人よりもずっと勉強しやすくなりました)。
(エチル基)のような骨組みの基(炭化水素基)と性質を決める働きの機能団(官能基)例えば-OH (ヒドロキシ基:アルコールかフェノールの性質を示す)、-COOH (カルボキシ基:カルボン酸の性質を示す)などです。これを組み合わせて示性式を作るのです。示性式から構造式を作るのは定石がありますからそれほど難しくありません。分子の存在するものは分子の構造を知れば”構造から性質を”が鉄則ですから、いろいろなことを読みとれます。分子模型はその意味で大事なものですが、スイス製のよいものですと1セット50万円くらいはします。構造式は立体としての感覚は欠けていますが、この模型の代用品です。分子そのものの「見取り図」です。(歴史的には示性式、構造式は人間が有機化合物を分類する為に便宜上考えた形式的なもので、実際の分子の形とは関係がないとされた時代があります。だからこそ未だに○○式といっていますが、現代では、実際の分子の形と密接に関係していることが機器分析からも証明できますから、分子の示性スケッチ、構造スケッチと考えればよろしい。昔の人よりもずっと勉強しやすくなりました)。
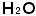 をみれば水の分子が水素原子2個と酸素原子1個でできていることが分かります。その上もう少し勉強が進んで構造式さらに分子の形、電気陰性度まで分かってきますと水の性質まで読みとれます。もう一歩進んで原子量、モルの勉強が済みますと
をみれば水の分子が水素原子2個と酸素原子1個でできていることが分かります。その上もう少し勉強が進んで構造式さらに分子の形、電気陰性度まで分かってきますと水の性質まで読みとれます。もう一歩進んで原子量、モルの勉強が済みますと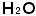 には量的なことまで含まれていることが分かります。ダイオキシンという日本語では何も分かりませんが、ダイオキシンの構造式を覚えようとするのでなしに、新鮮な目でじっくりと眺めますと、図のように塩化ビニール系の物質が廃棄物処理段階のある特定の温度で加熱される時、酸化を伴いつつ反応して、エネルギー的に安定な構造のダイオキシンに変わったのだろうと推定させてくれます(参照:琵琶湖の危機。誤解のないようにもうしますが、ダイオキシンは別のルート、つまり、未燃炭素と塩化水素や塩素とがフライアッシュなどの触媒作用を受けても出来ます)。最近塩化ビニール系の薬品を造っている会社も、ダイオキシン発生源として監視を受けることになりました。発想が遅すぎます。こういうわけで、化学式という「化学語」は化学を学ぶ人にとってなくてはならないすばらしい万国共通語なのです。構造式からスタートして、さらに立体的なことと分子の中で電子がどのように分布しているのかまで考えにいれて、構造とその分子の性質との関連に推理や想像を働かせて仕事をするところに専門的な有機化学の面白さがあるのです。高校時代「構造式から物質の性質を読みとる」という認識もなく、ここに書いたような訓練が出来ていないと、理工学系や薬学系大学に受験テクニックを駆使してうまく入れたとしても大変なのです。せっかく入れたのについていけなくて辞めてしまう学生もいるのです。
には量的なことまで含まれていることが分かります。ダイオキシンという日本語では何も分かりませんが、ダイオキシンの構造式を覚えようとするのでなしに、新鮮な目でじっくりと眺めますと、図のように塩化ビニール系の物質が廃棄物処理段階のある特定の温度で加熱される時、酸化を伴いつつ反応して、エネルギー的に安定な構造のダイオキシンに変わったのだろうと推定させてくれます(参照:琵琶湖の危機。誤解のないようにもうしますが、ダイオキシンは別のルート、つまり、未燃炭素と塩化水素や塩素とがフライアッシュなどの触媒作用を受けても出来ます)。最近塩化ビニール系の薬品を造っている会社も、ダイオキシン発生源として監視を受けることになりました。発想が遅すぎます。こういうわけで、化学式という「化学語」は化学を学ぶ人にとってなくてはならないすばらしい万国共通語なのです。構造式からスタートして、さらに立体的なことと分子の中で電子がどのように分布しているのかまで考えにいれて、構造とその分子の性質との関連に推理や想像を働かせて仕事をするところに専門的な有機化学の面白さがあるのです。高校時代「構造式から物質の性質を読みとる」という認識もなく、ここに書いたような訓練が出来ていないと、理工学系や薬学系大学に受験テクニックを駆使してうまく入れたとしても大変なのです。せっかく入れたのについていけなくて辞めてしまう学生もいるのです。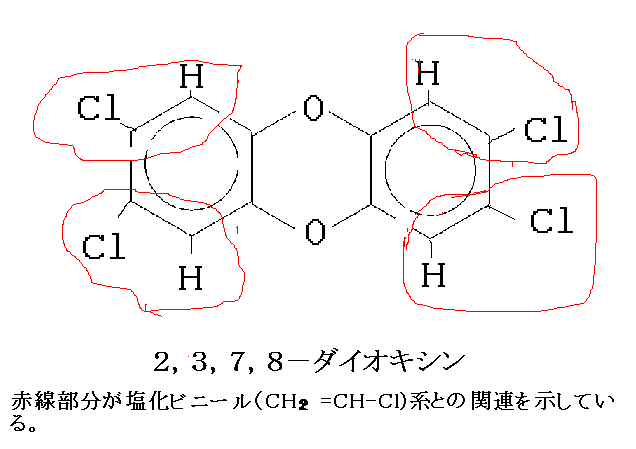
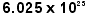 個の集団(これを1モルといいます) と解釈(マクロ(macro)の立場)されるときとがあります。どちらなのかは話の前後関係から判断します。分子1個は小さくてとても見えません。その質量も小さくて、g単位で表わすのは適当ではなく、“指標的な”(教科書には“相対的な”と書いてある)原子量単位で表現して約18ですが、1モルになると現実味を持ち、これにgを付けた18gの質量を持ち、肉眼でも立派に認知できます。“指標的な”というのは“基準に対して相対的な”ということです。消費者物価を“円”単位でいわずに“1990年を100とすると今年は110です”と表現するのと似ています。
個の集団(これを1モルといいます) と解釈(マクロ(macro)の立場)されるときとがあります。どちらなのかは話の前後関係から判断します。分子1個は小さくてとても見えません。その質量も小さくて、g単位で表わすのは適当ではなく、“指標的な”(教科書には“相対的な”と書いてある)原子量単位で表現して約18ですが、1モルになると現実味を持ち、これにgを付けた18gの質量を持ち、肉眼でも立派に認知できます。“指標的な”というのは“基準に対して相対的な”ということです。消費者物価を“円”単位でいわずに“1990年を100とすると今年は110です”と表現するのと似ています。